L1 점핑 유전자 활성화의 기원이 초기 배아 발생과정에 있음을 최초 제시
국제 학술지 ‘네이처(Nature)’에 게재
인체 노화 및 질환 발생을 제어하는 기술개발에 기여할 수 있을 것으로 기대

(대전=세종충청뉴스) 송윤영 기자 = 인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
KAIST(총장 이광형)는 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
KAIST 의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
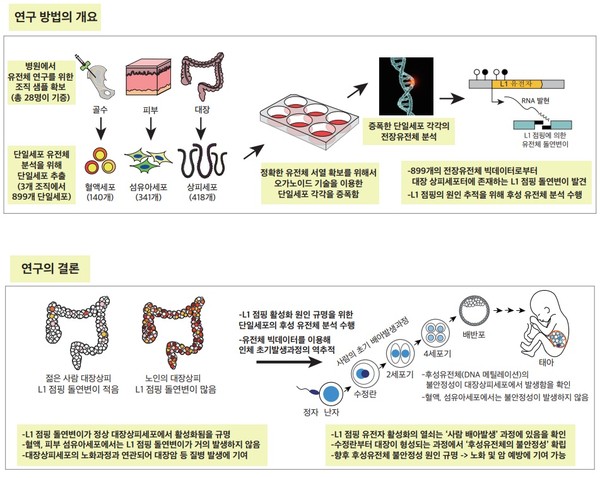
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
KAIST 의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
붙임 : 연구개요, 그림 설명, 용어 설명
□ 연구개요
배경
사람의 몸은 약 40조 개의 세포로 이루어져 있고, 각각의 세포는 세포 핵 안에 30억 염기쌍의 유전체를 가지고 있다. 일반적으로 한 명의 인체를 구성하는 각각의 세포는 같은 유전체 서열을 가지고 있다고 도식적으로 생각되나, 사람의 발생과정 및 노화과정에서 각각의 세포는 DNA 돌연변이를 “획득” 하게 되고 (체세포 돌연변이; somatic mutation), 각각의 세포의 유전 정보는 노화 과정에 따라 서로 다르게 변화하게 되며 이를 ‘체세포 모자이크’ (somatic mosaicism) 현상이라고 한다. 체세포 돌연변이에 의한 모자이크는 암 과 같은 질병을 일으키는 주된 원인이다. 유전체 기술의 급격한 발달로 인간의 단일세포 각각에 존재하는 돌연변이를 규명할 수 있는 수준에 이르렀으며, “KAIST 체세포 돌연변이 연구단”은 체세포 모자이크 현상을 체계적으로 규명하는 유전체 연구를 집중적으로 수행하고 있다.
본 연구는 인간의 유전체에 빈번히 존재하지만 진화과정 후에 “불활성화”되었다고 알려진 L1 (LINE-1;라인-1) retrotransposon (레트로트랜스포존; 전이성 이동인자; 점핑 유전자 라고 일반적으로 불림) 이 인간의 대장 세포에서 활성화되어있다는 것을 밝히고자 수행된 연구이다. L1은 인간 유전체 30억 염기쌍의 17%를 차지하며 약 50만 개의 L1 점핑 유전자가 유전체 상에 있다 (대부분은 불활성화 된 “화석” 상태로 있을 것으로 여겨짐). 연구 결과는 50만 개의 L1 점핑 유전자 중 수 십 개는 활성화 될 수 있으며, 인간의 여러 정상 (healthy) 세포 중 ‘대장 상피세포’에서 매우 활성화되어 유전체를 변형(파괴)하고 있음을 최초로 규명한 것이다.
2. 연구 내용
본 연구는 인간의 단일세포 유전체 차이를 정밀하게 규명하기 위하여 총 28명의 개인으로부터 기증받은 899개 단일세포의 전장유전체 (whole-genome) 서열 빅데이터를 생성하여 생명정보학 기법으로 분석하였다. 899개 단일세포 가운데 418개는 대장상피세포, 140개는 조혈모세포 (혈액), 341개는 피부 섬유아세포였다. 이들로부터 1,250개의 L1점핑유전자의 활성화에 의한 유전체 돌연변이를 발견하였으며, 이들의 99%는 대장상피세포에서 발견되었다. 이는 L1 점핑유전자의 활성화가 대장상피세포에서 특이적으로 활발하다는 것을 의미한다.
L1 점핑 유전자의 활성화에 의한 돌연변이는 나이가 많은 사람에서 기증받은 대장상피세포일수록 빈번히 발견되었으며, 이는 이들 돌연변이가 노화과정에서 확률적으로 일어난다는 것을 의미한다. 평균적으로 매 대장상피세포는 30년 마다 1개의 L1 점핑 유전자에 의한 돌연변이를 획득한다. 즉, 30세가 되면, 한 개인의 대다수의 대장 상피세포는 L1 점핑 유전자 돌연변이에 의해 유전체가 변형된다. L1 점핑 유전자 돌연변이는 배아 발생과정부터 시작되고 대장상피세포에서는 노화과정동안 평생 지속되는 것으로 추정되었다.
대장상피세포의 추가적인 multi-omics (DNA methylation 및 RNA-seq) 연구 결과, 대장상피세포에서 L1 점핑유전자의 재활성화는 L1 점핑유전자 발현을 조절하는 ‘프로모터’ 지역의 DNA 메틸레이션 이상 (탈메틸화 ; demethylation)에 의해 발생하였으며, 이들 DNA탈메틸화의 약 70%는 인체의 배아발생과정에서 형성되는 것으로 나타났다. 즉, DNA 탈메틸화 원인의 다수는 노화과정에서 노출되는 환경인자 때문이 아니라, 인체의 정상적인 배아발생과정(대장상피세포의 형성과정)에서 기인하는 것이다. 어떤 이유로 대장상피세포의 형성과정에서 이러한 탈메틸화가 형성되는지를 규명하는 것이 향후 연구의 중요 포인트가 될 것으로 생각된다.
3. 기대 효과
본 연구는 단일세포 정밀 유전체 연구의 대규모 수행을 통하여 새로운 생명현상을 규명할 수 있다는 것을 보여주었다. 유전체 돌연변이는 암 발생의 직접적인 원인으로서, 정상 세포에서의 돌연변이 발생 과정의 규명은 인간의 노화 및 암 발생과정을 추적하는 것이며, 질병(암) 예방 및 정밀의료에 도움이 될 수 있을 것으로 생각된다.
*트랜스포존 (점핑 유전자)
DNA 이곳저곳에 옮겨 다니며 자신을 복제하며 유전체를 불안정하게 만드는 기능을 가지고 있다. 점핑 “유전자” 라고 불리지만, 세포 기능에 필수적인 단백질을 생성하지는 않으며 . 인간 유전체 서열 가운데 약 40%는 트랜스포존이 점유하고 있으며, 이 중 L1 레트로트랜스포존은 17%를 차지한다. 레트로트랜스포존은 트랜스포존의 일종으로 ‘점핑’을 하는 과정에서 RNA를 매개로 한다. 트랜스포존은 오랜 진화과정에서 바이러스가 인체에 침투하여 남아있는 흔적으로 추정되며, 유전체 서열을 ‘섞는’ 촉매제 역할을 하여 진화의 동력으로 여겨졌다. 다만 개개인에서 이들이 활성화되면 유전체를 파괴하여 암 등 질환을 일으킬 수 있기 때문에 불활성화되거나 활성이 제어되어야 한다. 실제로 50만 개의 L1 점핑 유전자 (유전체의 17%를 차지)의 대다수는 불활성화된 ‘화석’상태이며, 수십-수백개의 L1점핑 유전자는 활성화될 수 있다고 여겨진다. (본 연구 결과 이 가운데 일부는 대장 상피세포에서 활성화됨이 증명되었다). 본 연구 이전에 암세포가 아닌 인체의 정상 세포에서 이들이 얼마나 활성화되는지는 알려진 바가 거의 없었다.